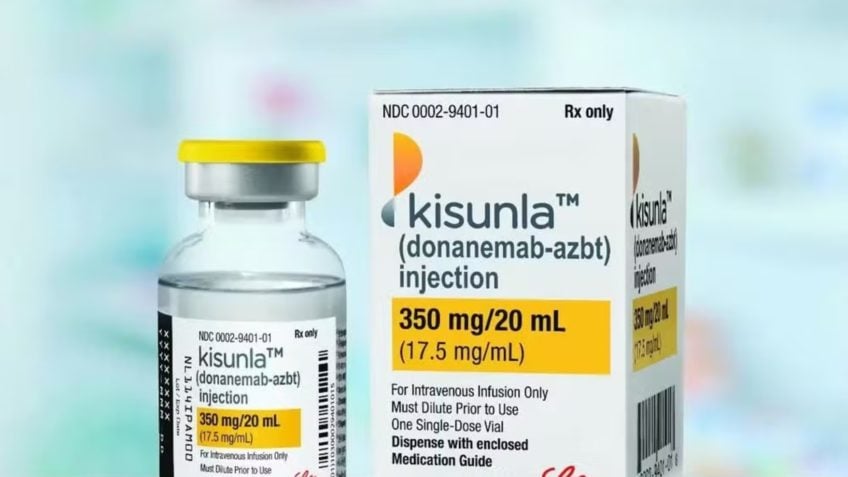
Aprovado nos EUA em 2024, o Kisunla, medicamento para fase inicial da doença, foi recebido com ceticismo por parte da comunidade médica
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou na 3ª feira (22.abr.2025) o Kisunla, 1º medicamento indicado para o tratamento de comprometimento cognitivo leve ou demência leve associados à Doença de Alzheimer em estágio inicial.
O remédio, fabricado no Brasil pelo laboratório Eli Lilly, tem como princípio ativo o donanemabe. Trata-se, segundo a agência, de um “anticorpo monoclonal que se liga a uma proteína chamada beta-amiloide”.
Na doença de Alzheimer, aglomerados de proteína beta-amiloide formam placas no cérebro. O donanemabe age nesses aglomerados, ligando-se a eles e reduzindo-os, para retardar, assim, a progressão da doença. Sua ação é semelhante a do Lecanemab, aprovado recentemente pela UE (União Europeia).
A doença de Alzheimer é neurodegenerativa, progressiva e irreversível e, até o momento, não tem cura. O tratamento promete desacelerar o avanço da perda de cognição.
O produto será comercializado em embalagem contendo 1 frasco-ampola de 20mL com 1 unidade. Cada dose de 20 mL é composta por 350 mg de substância ativa donanemabe, ou seja, cada mL do produto contém 17,5 mg de donanemabe.
O medicamento é contraindicado para pacientes:
- portadores do gene da apolipoproteína E ε4 (ApoE ε4), ou
- que estejam tomando anticoagulantes, ou
- que tenham sido diagnosticados com AAC (Angiopatia Amiloide Cerebral) antes de iniciar o tratamento.
Isso porque, nesses casos, os riscos à saúde são maiores do que os benefícios associados.
As reações adversas mais comuns do medicamento são reações relacionadas à infusão (que podem causar febre e sintomas semelhantes aos da gripe) e dores de cabeça.
A dose recomendada de Kisunla é de 700 mg por mês para as 3 primeiras doses, seguidas de 1.400 mg por mês, até a depuração da placa amiloide no cérebro ou por até 18 meses, para os casos em que o monitoramento não seja possível.
Aprovado nos EUA em 2024, o remédio foi recebido com esperança, mas também com ceticismo por parte da comunidade médica.
Estudo clínico
A avaliação do donanemabe foi feita a partir de um estudo clínico realizado em 2023 envolvendo 1.736 pacientes de 8 países com Alzheimer em estágio inicial.
Os pacientes receberam 700 mg de donanemabe a cada 4 semanas nas 3 primeiras doses e, depois, 1.400 mg a cada 4 semanas (860 pacientes) ou placebo (876 pacientes), por até 72 semanas.
Aqueles que receberam donanemabe apresentaram, de acordo com o estudo, progressão clínica menor em comparação aos pacientes tratados com placebo.
O estudo, porém, tem limitações, uma vez que “a coleta de dados foi de 76 semanas, limitando a compreensão de longo prazo do donanemabe”. Os autores do estudo clínico informaram, no entanto, que uma extensão da pesquisa está em andamento.
Outra questão apontada no artigo é que 91,5% dos pacientes eram pessoas brancas “o que pode limitar a generalização para outras populações devido à falta de diversidade racial e étnica”.
A Anvisa informou que, “como acontece com qualquer medicamento”, vai monitorar a segurança e a efetividade do donanemabe sob análise rigorosa.
Controvérsia na comunidade médica
Aprovado nos Estados Unidos em julho de 2024, o medicamento foi recebido no país com algum ceticismo por parte da comunidade médica em razão de riscos de segurança.
Michael Greicius, neurologista da Escola de Medicina da Universidade de Stanford, disse ao jornal New York Times que não prescreveria o Kisunla nem o Lecanemab, porque entende que os estudos não comprovam que os pacientes que tiveram mais placas de amiloide removidas apresentaram taxas mais lentas de declínio cognitivo.
Até o momento, segundo Greicius “não há correlação em nenhum de seus estudos entre a remoção de placas amiloides e a resposta clínica em pacientes individualmente”.
Já Joy Snider, professora de Neurologia da Faculdade de Medicina da Universidade de Washington, afirmou que, apesar de a desaceleração da progressão não ser “enorme”, pode ser significativa na vida das pessoas. Snider participou dos testes com o medicamento e atuou como consultora da farmacêutica Eli Lilly, responsável pela comercialização da Kisunla também nos EUA.
“Pelo menos em nível de grupo, a eliminação da amiloide se correlaciona com a desaceleração da progressão da doença”, disse ao New York Times. “Será difícil ver essas correlações em um paciente individual”, porque, segundo Snider, os problemas de memória e pensamento podem variar já que, durante o teste, “você não sabe se o paciente está tendo um dia bom ou ruim”.
Doença de Alzheimer
De acordo com o Ministério da Saúde, a doença de Alzheimer é um transtorno neurodegenerativo, progressivo e fatal que se manifesta pela deterioração cognitiva e da memória, pelo comprometimento progressivo das atividades de vida diária e por uma variedade de sintomas psiquiátricos e de alterações comportamentais.
A causa ainda é desconhecida, mas acredita-se que seja geneticamente determinada. A doença de Alzheimer é a forma mais comum de demência neurodegenerativa em pessoas idosas, sendo responsável por mais da metade dos casos de demência nessa população.
O Alzheimer costuma evoluir para vários estágios de forma lenta e inexorável, ou seja, não há o que possa ser feito para barrar o avanço da doença.
A partir do diagnóstico, a sobrevida média das pessoas acometidas por Alzheimer oscila entre 8 e 10 anos. O quadro clínico costuma ser dividido em 4 estágios:
- Estágio 1 (forma inicial): alterações na memória, na personalidade e nas habilidades visuais e espaciais;
- Estágio 2 (forma moderada): dificuldade para falar, realizar tarefas simples e coordenar movimentos. Agitação e insônia;
- Estágio 3 (forma grave): resistência à execução de tarefas diárias, incontinência urinária e fecal, dificuldade para comer e deficiência motora progressiva;
- Estágio 4 (terminal): restrição ao leito, mutismo, dor à deglutição e infecções intercorrentes.
Leia mais: